ヘルスケア スタートアップ
【AI医療機器開発連載・第3回】AI医療機器開発に関する臨床研究・医学系研究関連規制の適用

1 はじめに
本記事は「【連載】法規制、契約、知的財産の観点から見るAI医療機器開発」の第3回目の記事です。
【連載】法規制、契約、知的財産の観点から見るAI医療機器開発
第1 【第1回】AI医療機器の開発からサービス提供までの流れと法規制・契約
第2 医療データ収集段階の規制と契約
1 【第2回】AI医療機器開発のための医療データ収集と個人情報保護法
2 【第3回】AI医療機器開発に関する臨床研究・医学系研究関連規制の適用
第3 AI医療機器開発・ハードウェア製造段階の規制と契約
第4 治験・薬事承認・保険収載段階の規制と契約
第5 サービス提供段階の規制と契約
本記事では、AI医療機器開発に関する臨床研究・医学系研究関連規制をテーマに解説します。連載第1回目の記事の図でいうと、本記事のテーマは以下の箇所に該当します。
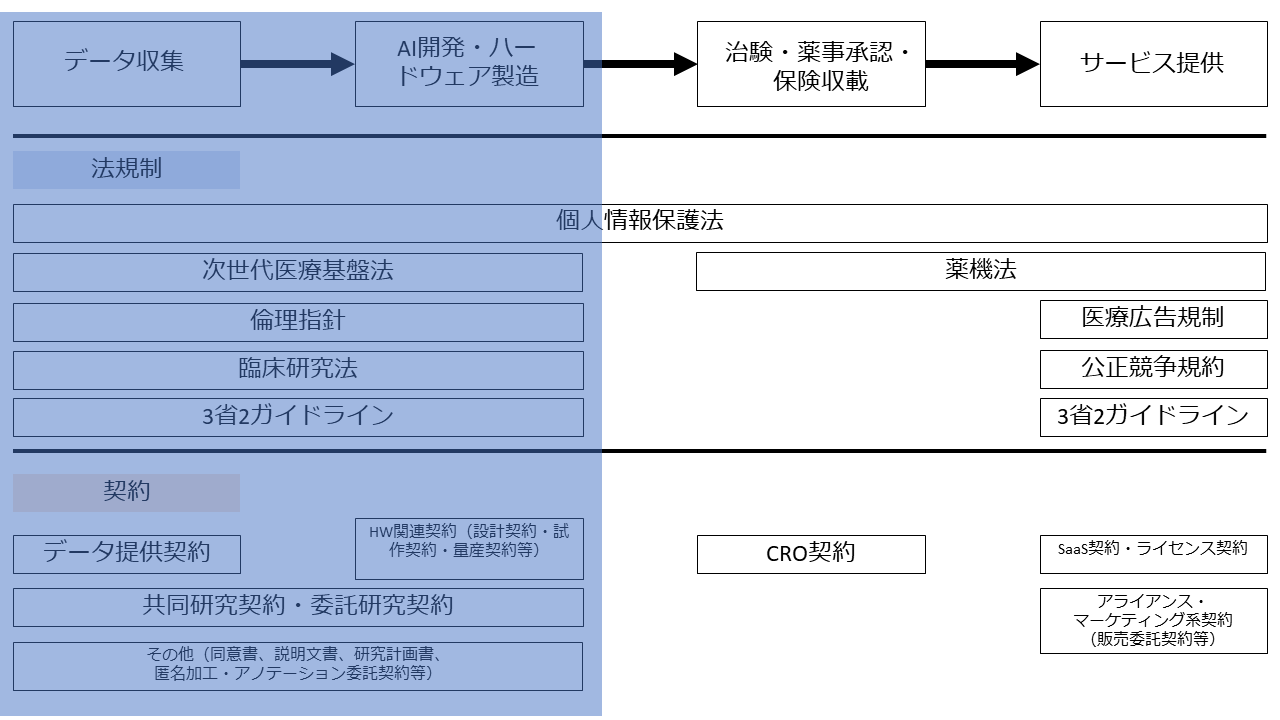
前回の「AI医療機器開発のための医療データ収集と個人情報保護法」では、AI医療機器のコアとなるAIモデルを作成するために用いる学習用データとして、患者の医療データを収集・利用する際に問題となる個人情報の保護に関する法律(以下「個人情報保護法」といいます)の観点から解説しました。
一方、AI医療機器開発の場面では個人情報保護法のみが問題となるのではなく、「臨床研究法」や「人を対象とする生命科学・医学系研究に対する倫理指針」といった、臨床研究や医学系研究そのものに対する規制の適用の有無も問題となります。
今回は前回と同様に、医療機器メーカーが、病院などの医療機関から患者の医療データの提供を受けてAI医療機器開発を行う場面を主に想定しつつ、臨床研究や医学系研究に関する規制についてご紹介します。
なお、「AI医療機器開発に臨床研究・医学系研究関連規制が適用されるのかどうか」という問題(研究規制の適用の有無の問題)と、「AI医療機器開発に臨床研究・医学系研究関連規制が適用されるとして、医療機器メーカーは何をしなければならないのか」という問題(研究規制の具体的な内容)の2つの観点がありますが、本記事では前者の「AI医療機器開発に臨床研究・医学系研究関連規制が適用されるのかどうか」という問題(研究規制の適用の有無の問題)をまずは取り扱います。
後者の方は、次回以降にご紹介することとします。
2 臨床研究・医学系研究に関する規制
臨床研究や医学系研究に関する規制としては、「臨床研究法」と「人を対象とする生命科学・医学系研究に関する倫理指針」(以下「生命・医学系指針」といいます。)があります。「臨床研究法」と「生命・医学系指針」の適用関係は相互に排他的であり1文部科学省 厚生労働省 経済産業省「人を対象とする生命科学・医学系研究に関する倫理指針 ガイダンス」 41頁において、「臨床研究法の定める、臨床研究実施基準(臨床研究法施行規則(平成 30 年厚生労働省令第 17 号)第8条~第 38 条)についても同様に、当該基準の適用範囲に含まれる研究は、原則としてこの指針の対象とならない。」とされています。、これらの適用の検討に際しては、より重い法律上の義務が課せられる「臨床研究法」の適用の有無を検討し(ここで臨床研究法の適用があれば生命・医学系指針は適用されません)、「臨床研究法」が適用されない場合に「生命・医学系指針」の適用の有無を検討することになります。
以下では、まず「臨床研究法」について解説し、その後「生命・医学系指針」について解説することとします。
3 臨床研究法について
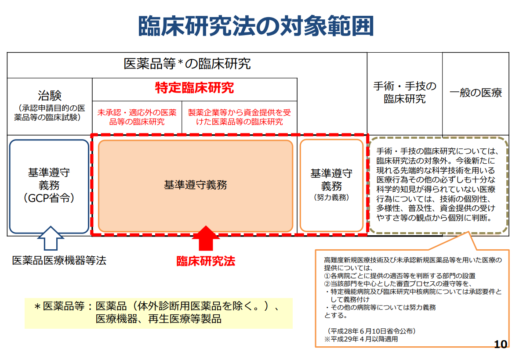
(1)「臨床研究」と「特定臨床研究」
臨床研究法は「臨床研究」と「特定臨床研究」の概念を区別して規定しており(前者が後者を含む関係にあります)、それらに対する規制の内容も全く異なっています。
(「特定臨床研究」ではなく、かつ「治験」にも該当しない)単なる「臨床研究」を行う場合には、同法第4条第1項を除いて臨床研究法の適用はなく、同条同項で「臨床研究実施基準」の遵守について努力義務のみ課されています。
一方、「特定臨床研究」を行う場合には、臨床研究法上の各規定と、厚生労働省令で定められた「臨床研究実施基準」を遵守する法律上の義務を負います(臨床研究法第4条第2項)。
この「臨床研究法」と「特定臨床研究」の区別については、厚生労働省が公開している「臨床研究法の概要」という資料のP10が分かりやすいので、以下に引用します。
(2)「特定臨床研究」の詳細
また「特定臨床研究」としては、以下の2つの類型があります。
・臨床研究法第2条第1号の「医薬品等製造販売業者又はその特殊関係者から研究資金等の提供を受けて実施する医薬品等の臨床研究」
・臨床研究法第2条第2号の「未承認・適応外の医薬品等の臨床研究」
このように定義上は「~の臨床研究」となっているとおり、「特定臨床研究」はいずれも「臨床研究」に該当することがそもそもの前提となっています。
そこで、以下では「臨床研究」とは何なのか、及びAI医療機器開発において特に問題となるポイントを概観します。
そもそも当該研究開発が「臨床研究」に該当しなければ、「臨床研究」及び「特定臨床研究」に関する法規制が適用されないことになりますので、重要なポイントとなります。
読者の皆様の中に医療機器メーカーの方々がいらっしゃる場合は、これから行おうとしているAI医療機器の開発が「臨床研究」に該当するのか、という観点からお読みいただければと思います。
(3)「臨床研究」について
ア「臨床研究」の定義
「臨床研究」とは、「医薬品等を人に対して用いることにより、当該医薬品等の有効性又は安全性を明らかにする研究をいう」とされています(臨床研究法第2条第1項)。
また、「医薬品等を人に対して用いること」とは、医薬品、医療機器又は再生医療等製品を人に対して投与又は使用する行為のうち、「医行為」を意味するとされます2厚生労働省医政経発0228第1号 平成30年2月28日「臨床研究法施行規則の施行等について」。
そして、厚生労働省「臨床研究法の施行等に関するQ&A(統合版)」(以下「Q&A」といいます)の「問1-3」には以下の記載があります。
問 1-3 「当該医薬品等の有効性又は安全性を明らかにする研究」の「有効性」には、医療機器の性能は含まれるか。
(答) 含まれる。
この「問 1-3」を前提とすると、「医療機器の性能を明らかにする研究」も「臨床研究」に含まれることになります。
そうするとここで問題となるのが、AI医療機器の開発が、「医療機器の性能を明らかにする研究」に該当するのか、という点です。
イ 開発段階のAIモデルの医療機器該当性
既に医療機器プログラムとして薬機法上の承認を得た段階のAIモデルが「医療機器」に該当することは明らかですが、本記事が前提とするような、「開発段階にあって、実際の画像診断支援には未だ用いることができないような精度のAIモデル」が、そもそも「医療機器」なのかという点が問題になります。
この点、薬機法上の「医療機器」の定義では、「人若しくは動物の疾病の診断、治療若しくは予防に使用されること、又は人若しくは動物の身体の構造若しくは機能に影響を及ぼすことが目的とされている機械器具等(再生医療等製品を除く。)であつて、政令で定めるものをいう。」(薬機法第2条第4項)とされ、「目的とされている」かどうかが重要な要素となります。
そうすると、あるAIモデルが医療機器に該当するかどうかは、当該AIモデルの具体的な精度とは無関係に、当該AIモデルの使用目的によって判断されると考えます。
そして、厚生労働省医薬・生活衛生局「プログラムの医療機器該当性判断事例」では「画像診断機器で撮影した画像や検査機器で得られた検査データを加工・処理し、病巣の存在する候補位置の表示や、病変又は異常値の検出の支援を行うプログラム」は医療機器に該当すると明言されているところ、例えば、そのようなプログラムとして使用されることを想定してAIモデルを開発しているのであれば、それが実用に耐えない精度の開発段階のAIモデルであっても「医療機器」に該当すると考えます。
ウ AI医療機器開発が「医療機器の性能を明らかにする研究」に該当するか
開発段階のAIモデルが「医療機器」に該当するとして、次に当該AIモデルの開発過程が「医療機器の性能を明らかにする研究」(上記Q&A「問 1-3」)と言えるのかが問題となります。
この点、AIモデルの開発段階においては、特定の精度を達成することを目標に、AIモデルに対してテストデータの入力や結果の出力を繰り返し、いわば試行錯誤しながら精度を評価しつつ、目標とする精度を達成していない場合には、学習用データセットの加工方法・学習方法・学習用プログラムの見直しを行って、最終的に目標とする精度を達成するために開発を進めていく、というプロセスをとります。
つまり、そもそもAIモデルの開発においては「開発対象となるAIモデルが、目標とする特定の精度を達成しているかどうか」という性能の評価を絶えず行っていることになります。
そうすると、「開発段階にあって、実際の画像診断支援には未だ用いることができないような精度のAIモデル」が「医療機器」に該当し得る以上は、当該AIモデルの開発過程においても「医療機器の性能を明らかにする研究」が行われていることになります。
エ AI医療機器開発において「医療機器を人に対して用いる」と言えるか
(a) 人に用いられる医療機器と性能の評価対象となる医療機器の一体性が問題となる場合
以上のイ及びウでは「臨床研究」の定義のうち、「当該医薬品等の有効性又は安全性を明らかにする研究」の部分に関して検討しました。
次に、「臨床研究」の定義のうち、「医薬品等(筆者注:医療機器も含まれます)を人に対して用いることにより」の部分についてですが、上記Q&A「問 1-3」をもあわせて考えると、「臨床研究」に該当するのは、「性能の評価対象となる医療機器を人に対して用いる場合」となります。
言い換えると、(ⅰ)人に対して用いる医療機器と、(ⅱ)性能の評価対象となる医療機器が一致している場合となります。
一見当然のことのように思えますが、AI医療機器開発では(ⅰ)と(ⅱ)が一致しているかどうか(下記で言及する「一体」と言えるかどうか)が判然としないケースが存在し、この点は「臨床研究」該当性の結論を分ける重要な要素となります。
例えば、以下の事例1で、「性能の評価対象となるAI医療機器を人に対して用いている(つまり(ⅰ)と(ⅱ)が一致する)」と評価できるでしょうか。
【事例1】
医療機器メーカーAが、外耳道内の腫れの様子から特定の疾病を判定するAI医療機器αを開発するため、耳鼻咽喉科のB病院の協力を得ることとした。
具体的にはB病院において、B病院が普段は利用していない外耳道内撮影用のペン型カメラβ(医療機器メーカーAが開発したものであり、医療機器の製造販売に係る薬機法上の承認を取得済み)を利用し、患者の外耳道内の画像を前向きに収集して、B病院から提供を受け、それらの画像を学習用データセットとして、AI医療機器開発に用いることとした。なお、カメラβの撮影態様としては、人の外耳道内にカメラβを挿入することにより、軽微な侵襲(=医行為)を伴うものとする。
上記事例1においては、実際に患者に対して用いられている医療機器(上記(ⅰ)に対応する医療機器)は「カメラβ」であり、医療機器メーカーAで開発途上の「(未承認の)AI医療機器α」(上記(ⅱ)に対応する医療機器)ではありません。
そうすると、仮に患者の外耳道内の画像を前向きに収集してAI医療機器を開発するとしても、そもそも上記の(ⅰ)及び(ⅱ)が一致しておらず、「性能の評価対象となるAI医療機器を人に対して用いていない」と言え、「臨床研究」に該当しないという整理が可能なのではないかとの疑問も出てきます。
もしそのように整理できるのであれば、AI医療機器開発の場面で臨床研究法の適用を免れることができ、医療機器メーカーAにとっては良い話であるはずです。
この点に関連して、厚生労働省の「臨床研究法の対象となる臨床研究等の事例集」(以下「事例集」といいます)の「3-11」に以下の記載があります。
「患者から血液、組織等の検体を採取し、又はCT等の画像検査を行い、その結果を独立した別の医療機器により測定・分析することにより、当該医療機器の性能を評価する研究は、その結果を研究の目的で診断や治療方針の決定に使用する場合を含めて、当該医療機器自体を直接患者に対して使用していないため、法に規定する臨床研究に該当しない。」
上記事例集3-11の記載が示すのは、「CT等の画像撮影を行う医療機器」(上記「事例1」で言えば「カメラβ」)と「結果の分析を行う医療機器」(上記「事例1」で言えば「(未承認の)AI医療機器α」)が別個独立したものであれば、性能評価対象となる医療機器(「(未承認の)AI医療機器α」)自体を直接患者に対して使用していないため(つまり前述の(ⅰ)と(ⅱ)が一致しないため)、「臨床研究」に該当しないということになりそうです。
一方で、事例集3-11には「留意事項等」として以下の記述もあり、「一体」の具体的な意味が何かというのが大きな問題となります。
「画像撮影を行う医療機器と分析を行う医療機器が一体となっている場合など、実質的に評価の対象となる医療機器を患者に対して使用している場合は、法に規定する臨床研究に該当する場合がある。」
この「留意事項等」の記載を前提とすると、本来は別々の医療機器である「(未承認の)AI医療機器α」と「カメラβ」が「一体」として評価される結果、カメラβを人に対して用いることにより、性能評価の対象である「(未承認の)AI医療機器α」を人に対して用いていると評価される可能性があるということになります。
では、事例集3-11の「留意事項等」が具体例として挙げる、「画像撮影を行う医療機器と分析を行う医療機器が一体となっている場合」とはどのような場合なのかが問題となります。
この点について、事例集には明確な解説は無いのですが、私見では「画像撮影を行う医療機器と分析を行う医療機器が一体となっている場合」の「一体」(以下「一体性」といいます)の解釈として、例えば以下のような見解があり得ると思われます。
▼ A説 「分析を行う医療機器」が「画像撮影を行う医療機器」に搭載されている、あるいは有線で接続されている等の、「別の医療機器ではあるが、物理的に一体となっている状態」の意味に限定して解釈されるとの考え方(「一体性」を、物理的に一体である場合に限定する考え方)
▼ B説 「分析を行う医療機器」と「画像撮影を行う医療機器」が物理的には相互に独立しているが、評価対象となる「分析を行う医療機器」への入力にとって、当該「画像撮影を行う医療機器」で撮影した画像でなければならないような関係にある場合には一体性を認める考え方(「一体性」を、機能的な関係性も考慮して判断し、A説よりも広げる考え方)
この点、厚生労働省は事例集やその他公式資料等で「一体性」の考え方について明言するものではないため、その解釈は不透明と言わざる得ず、実務的にはB説を前提に対応しなければならない可能性があります。
(b) 人に医療機器を用いる場合の侵襲等が無い場合
上記アのとおり、「医薬品等を人に対して用いる」とは、医薬品、医療機器又は再生医療等製品を人に対して投与又は使用する行為のうち、医行為に該当するものを行うことを指すとされます。
これに関連して、事例集3-10は、以下の場合について臨床研究に該当しないことを明示しており、かつ、医療機器の使用が医行為に該当する(侵襲を伴う)場合には臨床研究に該当する場合がある旨注記しています。
人に対して単に電極を装着して電位を測定するなど、医療機器を非侵襲的に人に対して使用し、その結果を研究の目的で診断や治療方針の決定には使用せず、他の検査結果と数値の比較のみ行うなどにより当該医療機器の性能を評価する研究は、法に規定する臨床研究に該当しない。
当該医療機器の使用が、侵襲(軽微な侵襲を含む。)を伴う場合には、医行為に該当するため、法に規定する臨床研究に該当する場合がある。
事例集3-10は、臨床研究の定義のうち、「医薬品等を人に対して用いる」に該当しない場合の具体的な例を示したものだと考えられます 。
例えば、以下の事例については、医療機器の使用が医行為に該当しない結果として、臨床研究に該当しないと整理できると考えられます。
【事例2】
医療機器メーカーAが、皮膚の外観から疾患の有無を判定するAI医療機器αを開発するため、皮膚科のB病院の協力を得ることとした。
具体的にはB病院において、B病院が普段は利用していないカメラβ(医療機器メーカーAが開発したものであって、AI医療機器αが搭載されている)を利用し、患者の皮膚の画像を前向きに収集して、AI医療機器αの精度を検証することとした。なお、カメラβの撮影態様としては、人の皮膚をカメラβで外観から撮影するのみであり侵襲は全く無く、また解析結果は診断に用いない。
オ 「観察研究」と「臨床研究」
いわゆる「観察研究」3「研究の目的で検査、投薬その他の診断又は治療のための医療行為の有無及び程度を制御することなく、患者のために最も適切な医療を提供した結果としての診療情報又は試料の収集により得られた情報を利用する研究」(臨床研究法施行規則第2条1号)は「臨床研究」には該当しないとされています(臨床研究法第2条1項、同施行規則第2条1号)。したがって、医療機器メーカーが、医療機関から、医療機関が既に保有するデータの提供を受ける場面(後ろ向きのデータ提供の場面)は、通常は「観察研究」に該当しますので、ほとんどケースで「臨床研究」に該当しないことになります。
また、医療機器メーカーが、医療機関から、医療機関においてこれから新たに取得する医療データの提供を受ける場面(前向きのデータ提供の場面)であっても、それが「観察研究」であれば、「臨床研究」に該当しません。ただ、前向きのデータ提供の場面において、例えば、その研究が無ければ本来は行わないような医療行為や検査を追加することが想定されているのであれば、それは「観察研究」とは言えず、「臨床研究」に該当する可能性があります。
4 生命・医学系指針について
(1)生命・医学系指針の性質について
生命・医学系指針は「法律」ではなく、同指針に違反した場合の罰則や制裁を直接定めた規定はありません。しかし、生命・医学系指針に違反した場合の不利益については以下のものが挙げられますが、いずれも不利益の程度が小さいとは言えず、生命・医学系指針の遵守は必須と考えられます。
- 国からの資金提供、研究費の打ち切りの可能性4厚生労働省HP においては、「以下の指針を遵守されず、厚生労働省等から改善指導が行われたにもかかわらず、正当な理由なく改善が認められない場合には、資金提供の打ち切り、未使用研究費等の返還、研究費全額の返還、競争的資金等の交付制限等の措置を講ずることがあり得ます。」との記載があります
- 主要な学会又は主要な学術誌での報告・掲載の拒否の可能性5例えば日本消化管学会では、学会発表、学会誌へ発表する際には、「人を対象とする生命科学・医学系研究に関する倫理指針」への遵守を要求しています
- 生命・医学系指針違反に起因するレピュテーションリスク6インターネットで「倫理指針違反」「公表」などと検索すると、多数の機関から、生命・医学系指針違反について公表している事例が確認できます。
(2) 生命・医学系指針の適用対象
生命・医学系指針の「第3 適用範囲」には、「この指針は、我が国の研究者等により実施され、又は日本国内において実施される人を対象とする生命科学・医学系研究を対象とする。」とあるため、「人を対象とする生命科学・医学系研究」(以下「生命科学・医学系研究」といいます)にどのような研究が含まれるかが問題となります。
この点、生命・医学系指針の「第2 用語の定義」に「生命科学・医学系研究」の定義がありますが、令和5年4月17日に改定された最新の「人を対象とする生命科学・医学系研究に関する倫理指針 ガイダンス」(以下「生命・医学系指針ガイダンス」といいます)において、「生命科学・医学系研究」の解釈について以下のとおり記載されています。
「生命科学・医学系研究」には、(中略)個人の健康に関する情報を用いた疫学的手法による研究及び質的研究、AIを用いたこれらの研究)も含まれる。
いわゆる「ゲノム指針」と統合される前の「人を対象とする医学系研究に関する倫理指針 ガイダンス」にはこのような記載はなかったこともあり、かつては「人の情報を用いて行われるAI医療機器開発に倫理指針は適用されるのか」という点について若干の議論もありましたが、上記引用部分の記載により、AI医療機器開発が「生命科学・医学系研究」に該当し、生命・医学系指針の適用対象となることが明らかとなっています。
なお、令和2年個人情報保護法改正により、「仮名加工情報」の概念が新設されましたが、令和4年3月31日付厚生労働省からの事務連絡によって、仮名加工情報である医療情報のみを用いて行うAI画像診断機器等の開発・研究等についても、生命・医学系指針の適用を受けることとされています。
(3)適用除外の規定
仮に、あるAI医療機器開発が「生命科学・医学系研究」に該当するとしても、ある特定の情報「のみ」を用いる「生命科学・医学系研究」である場合は、生命・医学系指針の適用が除外されることが明記されています(生命・医学系指針第3・1)。適用除外となるパターンはいくつかあるのですが、今回は実務上最もよく問題となる「既に作成されている匿名加工情報」のみを用いる場合についてご紹介します。
ウ 試料・情報のうち、次に掲げるもののみを用いる研究
(中略)
③ 「既に作成されている匿名加工情報」
具体的には、AI医療機器開発で利用される患者の医療データが上記③の「既に作成されている匿名加工情報」に該当することにより、当該AI医療機器開発が生命・医学系指針の適用を免れる場合があるかが問題となります。
まず、「既に」の日本語的な意味からすれば、「既に作成されている匿名加工情報」の解釈としては、(ⅰ)研究機関(AI医療機器開発においては医療機器メーカー)に提供されるまでの段階で「既に」匿名加工情報に加工されていればよい、(ⅱ)生命科学・医学系研究(AI医療機器開発においては当該開発)に関する研究計画書が作成されるまでの段階で「既に」(あるいは作成後であっても当該研究とは無関係に)匿名加工情報に加工されていることが求められている、等の考え方があり得ます。
つまり、どの時点から見て「既に」と言えるのかという観点から、解釈としては主に上記(ⅰ)や(ⅱ)の考え方があり得るということです。
この点、生命・医学系指針ガイダンス41頁及び42頁では上記のうち(ⅱ)の見解を採用することが明言されており、「既に作成されている匿名加工情報」とは「①研究計画書が作成されるまでに既に存在する情報及び②研究計画書の作成以降に取得された情報であって、取得の時点においては当該研究計画書の研究に用いられることを目的としていなかったものを指す」とされています。
そうすると、医療機器メーカーが医療機関からAI医療機器開発のために医療データの提供を受ける場面で、当該医療データが「既に作成されている匿名加工情報」に該当するのは、極めて限定的であると言えます。
通常、医療機関が何らの生命・医学系研究も想定せずに、わざわざ手間をかけて自己が保有する医療情報を匿名加工情報に加工しておくというケースはほとんど無いと思われるためです。
そのため、「既に作成されている匿名加工情報」とは、実際には「医療機関側が以前に別の生命・医学系研究のために作成した匿名加工情報」等に限られると思われます。
一方で、医療機器メーカーが、以前AI医療機器の開発に用いたデータセットを再度用いて、異なるAI医療機器の開発を行う場面では、当該データセットが「既に作成されている匿名加工情報」に該当するケースは、ある程度想定されると思われます。
つまり、例えば医療機器メーカーが既に一度倫理審査委員会の承認を経て、新たに作成した匿名加工情報のみを学習用データセットとしてAI医療機器開発を行い、その後、別のAI医療機器開発を当該学習用データを用いて行おうとする場合には、その学習用データは、2回目以降の開発(生命・医学系研究)との関係では、「既に作成されている匿名加工情報」に該当しますので、生命・医学系指針の適用は無いということになります。
5 おわりに
今回は、臨床研究・医学系研究関連規制の少々複雑な議論についてご紹介しましたが、次回以降では、「AI医療機器開発に臨床研究・医学系研究関連規制が適用されるとして、医療機器メーカーは何をしなければならないのか」という問題(研究規制の具体的な内容)についてご紹介する予定です。
特に、スタートアップである医療機器メーカーがAI医療機器開発を行う際によく適用される生命・医学系指針を中心に、研究計画書記載の留意点や、インフォームド・コンセント規制で実務上よく問題になる点等、より実践的な内容をご紹介したいと思います。
- 1文部科学省 厚生労働省 経済産業省「人を対象とする生命科学・医学系研究に関する倫理指針 ガイダンス」 41頁において、「臨床研究法の定める、臨床研究実施基準(臨床研究法施行規則(平成 30 年厚生労働省令第 17 号)第8条~第 38 条)についても同様に、当該基準の適用範囲に含まれる研究は、原則としてこの指針の対象とならない。」とされています。
- 2厚生労働省医政経発0228第1号 平成30年2月28日「臨床研究法施行規則の施行等について」
- 3「研究の目的で検査、投薬その他の診断又は治療のための医療行為の有無及び程度を制御することなく、患者のために最も適切な医療を提供した結果としての診療情報又は試料の収集により得られた情報を利用する研究」(臨床研究法施行規則第2条1号)
- 4厚生労働省HP においては、「以下の指針を遵守されず、厚生労働省等から改善指導が行われたにもかかわらず、正当な理由なく改善が認められない場合には、資金提供の打ち切り、未使用研究費等の返還、研究費全額の返還、競争的資金等の交付制限等の措置を講ずることがあり得ます。」との記載があります
- 5例えば日本消化管学会では、学会発表、学会誌へ発表する際には、「人を対象とする生命科学・医学系研究に関する倫理指針」への遵守を要求しています
- 6インターネットで「倫理指針違反」「公表」などと検索すると、多数の機関から、生命・医学系指針違反について公表している事例が確認できます。